Términos de Palabras Clave:
Artritis Reumatoidea Uncaria tomentosa
Prueba Clínica Medicina Complementaria
Uncaria tomentosa (Willd.) DC. Es una enredadera gigantesca de la familia de Rubiaceae, sub-familia Cinchonoidae, que crece en la selva amazónica del Perú. Por sus espinas curvadas, esta enredadera, así como otras 16 diferentes especies de plantas, también han sido llamadas “uña de gato” en Español y “Cat’s Claw” en Inglés. El interés específico y comercial en Uncaria tomentosa (UT) fue despertado por reportes de curas milagrosas de enfermedades como artritis, cáncer, asma, úlceras estomacales, inflamación de las vías urinarias, abscesos y desorden en el proceso de curación de heridas.
Intentos de extraer potencialmente los componentes terapéuticos de esta planta fue lo que llevó al descrubrimiento de 2 quimo-tipos de UT con un patrón diferente de alcaloide oxindole tetracíclico (TOA) o alcaloide oxindole pentacíclico (POA)1. Componentes de glicósidos de ácido quinóvico, esterol, epicatechine y ubicuo fueron encontrados en los dos quimo-tipos. Se descubrió que el POA tiene un efecto inmunomodulador Además de aumentar la fagocitosis, como ha sido reportado por otras plantas con igual efecto inmunomodulador, el POA demostró que inhibe la proliferación de los linfocitos activos circulantes mientras que estimula la proliferación de los linfocitos activos en reposo y que son muy sensibles. Estos efectos fueron antagonizados o inhibidos por TOA3.
Preparaciones derivadas de UT son ya usados como medicamentos complementarios, sin embargo, sin suficiente evidencia clínica de su seguridad ni eficacia. Nosotros iniciamos un estudio al azar de placebo control, para evaluar los efectos del extracto de UT-libre de TOA bien caracterizada y estandarizada en pacientes con artritis reumatoidea activa (AR) y que eran tratados con sufasalazina o hidroxichloroquina.
MATERIALES Y METODOS
Pacientes. Cuarenta pacientes de 20 años o más, o aquellos que llenaron el criterio del American College of Rheumatology para AR4 con la clase funcional de Steinbrocker II o III5 fueron alistados en el estudio. La enfermedad fue considerada activa cuando 3 de los siguientes 4 criterios fueron llenados: > 6 articulaciones con dolor, > 3 inflamadas, rigidez matutina > 30 min. Indice de sedimentación eritrositaria (ISD) > 25 mm/h, o Proteina C-reactiva (PCR) > 20.0 mg/I. Todos los pacientes fueron tratados con sulfasalazina o hidroxichloroquina por un período de por lo menos 6 meses; en las 6 semanas antes del alistamiento en el estudio, los pacientes tuvieron que tomar una dosis establecida de estos medicamentos. Medicamentos anti-inflamatorios sin esteroides (NSAID) y prednisolona hasta 10 mg/diario o su equivalente fueron permitidos.
Pacientes con enfermedades co-existentes como hematológica, renal, hepática, cardiovascular, neurológica fueron excluidos del estudio. Infecciones crónicas o eventos neoplásicos en el historial medico fueron consideradas razones para exclusión del estudio, también. Pacientes con historia de abuso de alcohol o drogas y aquellos que tendrían poca obediencia fueron excluidos. En las 4 semanas anteriores y durante el curso del estudio, a los pacientes no les fue permitido usar inyecciones de esteroide en tejidos blandos, intra-articular o intramuscular. Las mujeres embarazadas o madres que estaban amamantando no fueron enlistadas en el estudio.
Diseño del estudio. El estudio se llevó a cabo en 2 fases en el Rheumatological Outpatient Unit of Innsbruck University Hospital. En la primera fase de 24 semanas, el estudio fue diseñado para ser aleatorio y de control placebo. Durante este periodo, los pacientes recibieron una cápsula del extracto de planta o placebo 3 veces al día mientras continuaron con su terapia antereumática habitual. En la segunda fase, todos los pacientes recibieron el extracto de planta.
La contribución clínica fue efectuada por el mismo investigador (EM) al comienzo del estudio y a las 4, 8, 16, 24, 36 y 52 semanas subsecuentemente. El número de articulaciones inflamadas (fuera de 66) y de articulaciones dolientes (fuera de 68) y el Ritchie Index6 determinado, y los pacientes se les pidió que valoraran el dolor y la actividad de la enfermedad con una pesa analógica visual (VAS). La rigidez matutina fue medida en una escala de 5 pasos (0 = no rigidez matutina, 1 = <30 min, 2 = 30-60 min., 3 = 1-2 h, 4 = 2-4 h, 5 = > 4 h). Al comienzo del estudio, y 24 semanas subsecuentemente, y al final del estudio, la capacidad funcional de cada paciente fue determinada con el Health Assessment Questionnaire (HAQ)7. La seguridad fue monitoreada por examenes fisicos, presión sanguínea, índice del pulso y dimensiones de temperatura del cuerpo así como por el peso del cuerpo. Los estudios de laboratorios incluyeron ESR, CRP, factor reumatoideo (FR), anticuerpos antinucleares, conteo sanguíneo completo, y variables hepáticas y renales.
Medicación del estudio. Cápsulas de Krallendorn® (Immodal Pharmaka GmbH. Volders, Tyrol, Austria) conteniendo 20 mg de un extracto seco, extracto-acido acuoso, de Radix Uncariae tomentosae (Willd.) DC. Mod. Pent., con 14.7 mg/g POA y no TOA. Lactosa 130 mg y ácido ascórbico 200 mg por cápsula fueron usados como rellenantes. Con la excepción de los ingredientes activos, el placebo tenía los mismos ingredientes.
Análisis estadístico. Un análisis intento-a-tratar fue efectuado. Estadísticas descriptivas incluyeron un indice valor con medidas de dispersión. Para comparación de las variables dependientes en diferentes período de tiempo el examen no-paramétrico de Wilcoxon y Friedman fueron usados; el examen de Mann-Whitney fue aplicado para comparación entre el grupo del extracto de UT y el de placebo. Un valor de p < 0.05 considerado significante. Los cáalculos estadisticos fueron llevados a cabo con SPSS, versión 9.0.
RESULTADOS
Información demográfica. La característica de los pacientes está presentada en la Tabla 1. No hubo diferencia estadística entre los 2 grupos en relación a sexo, duración de la enfermedad, medicación, admisión de corticosteroides, y valores cíinicos y de laboratorios, con la excepción de CRP (valores más altos en el grupo de placebo).
Entre los 40 sometidos, 19 fueron aleatorio al grupo de placebo y 21 al grupo del extracto de UT. Durante el estudio, un paciente de cada grupo abandonó el estudio por razones adversas, y un paciente del grupo del extracto de la planta lo abandonó después de un mes de tratamiento por ineficacia del medicamento.
Eficacia clínica. Fase I (extractro-UT o placebo). Comparación de los 2 grupos al final de la primera fase del estudio nos enseñó que los pacientes en el grupo del extracto tenían menos coyunturas dolientes que aquellos en el grupo placebo (reducción de 53.2 vs 24.1%; p = 0.044. Ninguna diferencia fue observada entre los 2 grupos en las otras variables.
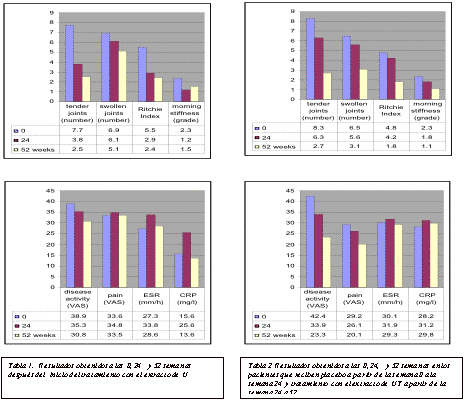
En los pacientes que estaban tomando el extracto de planta hubo una reducción en el número de coyunturas delicadas (p=0.001), Ritchie Index (p=0.002), así como en la duración de rigidez matutina (p=0.002) después de 24 semanas al compararse con el valor de la línea de referencia; donde los pacientes tomando el placebo, el número de coyunturas delicadas, Ritchie Index, y la duración de rigidez matutina no fue significativamente reducida (Figuras 1 y 2). Ningún cambio fue detectado en el número de coyunturas inflamadas, evaluación de pacientes de la actividad de la enfermedad, evaluación subjetiva al dolor, y los variables de laboratorio excepto por un aumento en el nivel de RF en el grupo de placebo (p=0.041).
Fase 2 (extract-UT). El consumo del extracto-UT resultó en un número reducido de las coyunturas dolientes (p < 0.001), Ritchie Index (p = 0.001), y la duración de rigidez matutina (p = 0.004) al compararse con el valor de la línea de referencia de la Semana 0 (Figura 1). Ningún cambio fue notado en las otras variables clínicas y en los valores de laboratorios.
En pacientes que recibieron el extracto de la planta sólo durante la segunda fase, hubo una reducción en el número de las articulaciones dolorosas (p = 0.003), número de articulaciones inflamadas (p = 0.007), y Ritchie Index (p= 0.004) en comparación a los valores observados al final de su tratamiento con placebo (Figura 2). Hubo una disminución en la intensidad de dolor y de la actividad de la enfermedad según fue valorado por los pacientes y la duración de la rigidez matutina; sin embargo, ninguno de estos cambios alcanzó significancia estadística. Entre los valores de laboratorio hubo una reducción en el RF de 135 a 32; esto también, conjuntamente con las medidas de laboratorio, no fue estadísticamente significativo.
No hubo cambio en el HAQ en ninguno de los dos grupos cuando lo comparamos con los valores de la línea de referencia al final de la primera base.
Seguridad. Durante la primera fase, eventos adversos ocurrieron en 12 pacientes de los 2 grupos (Tabla 2). Un paciente tomando el extracto-UT se retiró del estudio debido a gastritis y un paciente del grupo placebo se retiro debido a diarrea. En la segunda fase, otros 7 efectos secundarios fueron observados, ninguno de los cuales pudo ser atribuido claramente al consumo del tratamiento. Ningún efecto secundario mayor fue notado en el grupo activo así como en el grupo placebo.
Tabla 1. Demografía delos pacientes al comienzo del estudio.
|
Extracto UT n=21 |
Grupo Placebo, N=19 |
|
|
Edad, media ± SD, años Mujer/hombre Duración de dolencia,media ± SD, años Articulaciones sensitivas, media ± SD Articulaciones inflamadas, media ± SD Rigidez matutina, grado media ESR, mm/l h, media ± SD CRP, mg/l, media ± SD RF poitivo Sulfasalazina/hidroxichloroquina Pacientes tomando prednisolona |
53.1 ± 13.4 20/1 6.1 ± 5.7 7.9 ± 3.0 7.0 ± 4.2 2.3 27.3 ± 19.4 15.6 ± 16.9 10 18/3 7 |
54.9 ± 13.5 15/4 7.9 ± 8.3 8.4 ± 4.4 6.3 ± 2.8 23 30.1 ± 19.7 28.1 ± 25.3 8 17/2 8 |
Tabla 2. Reaccioones adversas. Relación al Tratamiento: 1 = definitivamente no, 2 = probablemente no, 3 = posiblemente, 4 = probablemente, 5 = definitivamente
|
Extract UT |
Placebo |
|||
|
No. de Pacientes |
Relación al Tratamiento |
No. de Pacientes |
Relación al Tratamiento |
|
|
Dispepsia Infección Respiratoria Dermatitis Prurito Conjuntivitis Influenza Gastritis Herpes zoster Infec. tracto urinario Fatiga Diarrea Dolor de cabeza Dolor de muelas |
2 2 0 2 1 1 1 1 1 1 0 0 0 |
2;2 2;3 -- 2;2 2 2 2 2 2 2 -- -- -- |
2 1 2 0 1 1 1 1 0 0 1 1 1 |
2;4 2 2;3 -- 2 2 3 2 -- -- 4 2 2 |
DISCUSION
Un número creciente de pacientes con AR están escépticos sobre la medicina anti-reumática convencional. Ha sido reportado que hasta un 40% de pacientes reumatológicos visitan a un practicante de medicina complementaria en el transcurso de su enfermedad8. La falta de recibir suficiente alivio de los medicamentos ortodoxos es la mayor razón por la cual los pacientes se vuelven a propuestas complementarias9.
Muchos de los pacientes creen que los medicamentos derivados de plantas tienen menos efectos secundarios, y al menos alguna eficacia.. Es por eso que extractos de una serie de variedad de plantas son muy usados por pacientes con enfermedades reumáticas, aunque la eficacia de la mayoría de estas preparaciones no han sido substanciadas con evidencia adecuada. En adición, algunas terapias herbales reportaron tener pertinentes efectos secundarios clínicos. Tomando estos factores en consideración hay una demanda para investigación de la eficacia y seguridad de esta forma de medicina complementaria10-12.
Según una larga tradición de los Indios Ashaninka del Perú, dice que plantas selectas de Uncaria tomentosa sirven como un remedio para las enfermedades reumáticas1. In vitro, un extracto de planta-UT conteniendo POA reveló un efecto inmunomodulador, el cual es antagonizado o inhibido por TOA3. Un extracto libre de alcaloides de UT demostró que sirve para mejorar la regeneración del DNA13. Otro extracto de UT conteniendo POA reportó que inhibe la producción del factor-α de necrósis tumoral y a tener efectos antioxidantes14. Sin embargo, la información sobre la eficacia clínica de UT en pacientes con enfermedades reumáticas está muy esparcida.
Este estudio demuestra que un extracto libre de TOA del quimotipo pentacíclico de UT, en combinación con sulfasalazina o hidroxichloroquina, tiene algunos efectos clínicos favorables en la Artritis Reumática (AR). Al final del estudio de la fase placebo-control, el número de articulaciones adoloridas en pacientes tratados con el extracto de UT fue reducido en comparación al grupo placebo, en tanto que el número de articulaciones inflamadas, el Ritchie Index, y la rigidez matutina no fue afectada. Seguimiento a pacientes tratados sobre un período total de 52 semanas reveló una mejoría clínica continuada, con la reducción en el número de las articulaciones sensibles, el Ritchie Index, y rigidez matutina al ser comparado con los valores de la línea de referencia. Estos resultados sugieren que un extracto libre de TOA del quimotipo pentacíclico de UT tiene un potencial efecto terapéutico cuando se combina con medicamentos convencionales usados en esta enfermedad, corticosteroides y NSAID. La dosis diaria de 60 mg de un extracto-ácido acuoso seco de extracto TOA-libre de UT puede ser considerado como tolerable y seguro. No hubo ningún efecto secundario claramente atribuido al extracto de UT y ambos el número y calidad de los efectos secundarios del extracto de UT fueron comparables al del placebo. La evaluación de las variaciones en la dosis y su repercusión en la tolerancia y eficacia tiene que ser examinada en un estudio mayor de placebo-control.
El extracto libre de TOA del quimotipo pentacíclico de UT administrado en este estudio representó un agente purificado y bien definido conteniendo un volumen de POA definido y estandarizado, en tanto que muchos otro productos herbales carecen de una especificación clara de sus ingredientes. En realidad, la mayoría de los productos de uña de gato disponibles en los establecimientos de productos naturales varían en la calidad y cantidad en sus contenidos15,16. Ambos, el total de los alacaloides y el porcentaje de alcaloides pentacíclicos varían sobre una gran escala en los extractos indefinidos de UT. Igual que diferentes lotes del mismo producto pueden mostrar variaciones considerables de ingredientes16.
Desde el punto de vista fitoquímico las especies de plantas no son fuentes homogéneas de materia prima. Hay variaciones en componentes en muchas especies de plantas dependiendo de los factores externos como el clima y la luz en cuanto que la herencia puede causar el desarrollo de diferentes quimotipos como en UT. En vista de estas circunstancias, altas normas de fabricación y control de calidad en la produción de medicamentos herbales son necesarios para proveer remedios herbales con una clara especificación de sus ingredientes. Aunque hay evidencia para la seguridad y la eficacia de algunas terapias herbales, este tipo de tratamiento puede ser solamente aceptado para tratar la enfermedad reumática cuando la preparación especifica ofrece una bien definida y estandarizada medicación que ha demostrado ser efectiva y segura en pruebas clinicas de control adecuado.
En lo concerniente al extracto libre de TOA del quimotipo pentacíclico de Uncaria tomentosa, con base a su seguridad relativa y modestos beneficios en las articulaciones sensibles comparado al placebo, según se evidenció en este pequeño estudio preliminar, se recomienda un estudio placebo-control de mayor alcance y duración.
REFERENCIAS
1.Keplinger K, Laus G, Wurm M, Dierich MP, Teppner H. Uncaria Tomentosa (Willd.)DC -Ethnomecial use and new phamaceutical, toxicological and botanical results.
J Ethnopharmacol 1999;64:23-34.
2.Wagner H, Krntzkamp B, Jurcic K. Die Alkaloide von Uncaria tomentosa and the Phagozytose-steigrnde Wirkung. Planta Med 1985;51:419-23.
3.Wurm M, Kacani L, Laus G, Keplinger K, Dierich MP. Pentacyclic oxindoles alkaloids from Uncaria tomentosa induce human endothelial cell to release a lymphocyte-proliferation-regulating factor. Planta Med 1998;64:701-4.
4.Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis, Arthritis Rheum 1988;31:315-24.
5. Steinbrocker O, Traeger CH, Batterman RC. Therapeutic criteria in rheumatoid arthritis. JAMA 1949;140:659-62.
6.Ritchie DM, Boyle JA, McInnes JM, et al. Clinical studies with an articualr index for the assessment of joint tenderness in patients with rheumatoid arthritis. Q J Med 1968;37:393-406.
7.Fries JF, Spitz P. Kraines RG, Holman HR. Measurement of patient outcome in arthritis. Arthritis Rheum 1980;23:137-45.
8.Vecchio PC. Attitudes to alternative medicine by rheumatology outpatient attenders. J Rheumatol 194;21:145-7.
9.Vincent C, Furnham A. Complementary medicine: A research perspective. Chichester: Wiley & Sons;1997.
10. Little C. Parsons T. Herbal therapy for treating rheumatoid arthritis (Cochrane Review). Cochrane Database Syst. Rev 2001;1CD002948. [abstract: hap//209.242.147.2/Abs/ab002948.htm]
11. Klepser TB, Klepser ME. Unsafe and potentially safe herbal therapies. Am J Health Syst Pham 1999;56:125-38.
12. van Haselen RA. Research on complementary medicine in rheumatic diseases: the need for better quality studies and reproduction of claimed positive results. Rheumatology 1999;38:387-90.
13. Sheng Y, Bryagelsson C, Pero RW, Enhanced DNA repair, immune function and reduced toxicity of C-MED-100, a novel aqueous extract from Uncaria tomentosa. J Ethnopharmacol 2000;69:115-26.
14. Sandoval M, Charbonnet RM., Okuhamma NN et al. Cat’s Claw inhibits TNF alpha production and scavenges free radicals: role in cytoprotection. Free Radic Biol Med 2000;29:71-8.
15. Reinhard RH, Uncaria tomentosa (Willd.) DC:Cat’s Claw, uña de gato, or saventaro. J Altern Complement Med 1999;5:143-51.
16. Laus G, Keplinger K, Wurm M, Dierich MP, Pharmacological activities of two chemotypes of Uncaria tomentosa (Willd.) DC [abstract]. In: Jurenitsch J, Kopp B, Kubelka W, editors. Proceedings of the 46th Annual Congress of the Society for Medical Plant Research 1998, Aug. 31-Sept. 4. Vienna: Society for Medical Plant Research; 1998:J61.